Akkor beszélünk inzulinrezisztenciáról (IR), ha normális anyagcsere-állapotban az elvárható inzulin mennyisége a szénhidrát-anyagcsere normalizálásához szubnormális hatást fejt ki. Jelen tájékoztató az inzulinrezisztencia kialakulásának főbb szempontjait és következményeit foglalja össze. Szakmai okok miatt elkerülhetetlen volt néhány olyan kifejezés használata is, ami laikusok számára talán nehezebben érthető. Terjedelmi okok miatt az ismertető nem tér ki az inzulintermelődés, a kiválasztás (szekréció) és a hatás területeire (inzulin-gén, inzulinreceptor génje, IRS-1 és-2 génjei, calpain gén), az energia-homeosztázis szabályozására (pl. leptin, leptin receptor és adiponektin génjei) továbbá a krónikus gyulladást okozó genetikai tényezőkre (pl. TNF-α, IL-6), a fibrinolízist (PAI-1 gén). (G.S.)
TARTALOM
1. Röviden az inzulin élettani szerepéről
2. Inzulinrezisztencia fogalma és jelentősége
3. Az inzulinrezisztencia kialakulásának mechanizmusai
4. Az inzulinrezisztencia következményei
1. Röviden az inzulin élettani szerepéről
Az inzulin hatásai között alapvető zsírsejtek és az izomrostok glukózfelvételének szabályozása. Az inzulin a tápanyagok raktározását és a transzporttápanyagok vérszintjét főként a vázizomzatra, a zsírsejtekre és a májsejtekre hatva szabályozza. Az inzulinnak azonban a szervezet legtöbb sejtjén érvényesül valamilyen hatása. Az inzulin a hasnyálmirigy Langerhans-szigeteinek béta sejtjeiben termelődik. A vércukor emelkedésére ezek a sejtek fokozzák inzulin termelésüket, mely bejut a keringésbe.
Az inzulin az inzulinreceptorokhoz kötődik a test egyes sejtjeihez, amin keresztül a sejtek a glükózt fel tudják venni.
A glükóz átjutása a sejtmembránon
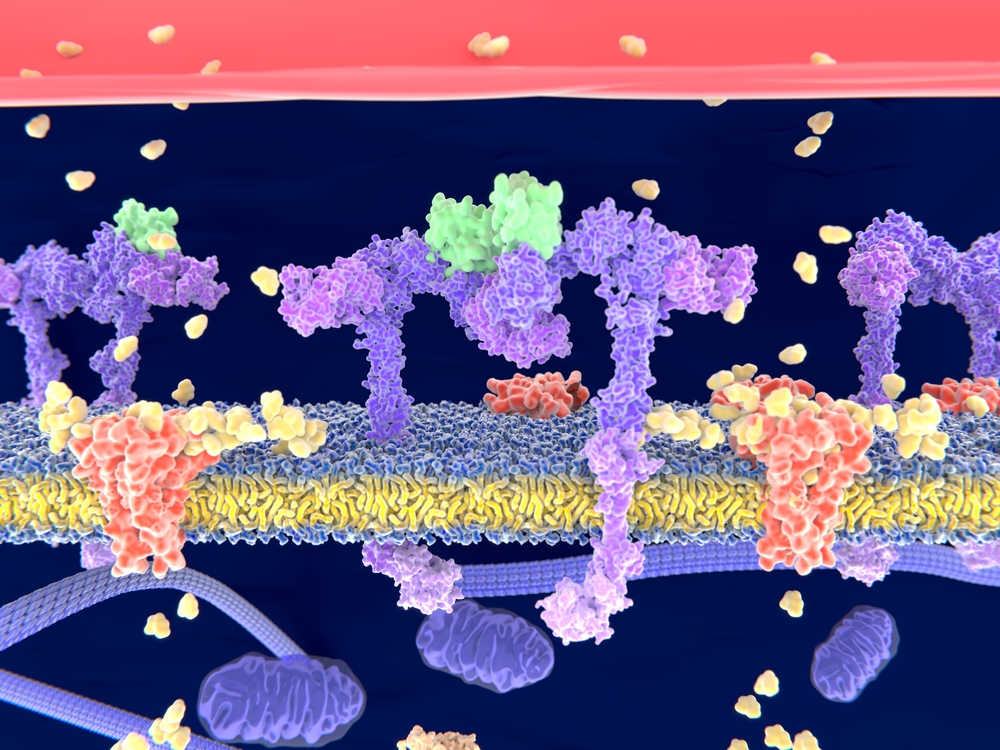
(forrás: Depositphotos_250918296_m-2015.jpg)
Magyarázat: inzulin: zöld, inzulinreceptor: lila, glükóz: sárga
A sejtek a bejutott glükózt energiaforrásként használják fel, valamint egyes sejtek (máj és izom) képesek a glükóz tárolására is, glikogén formájában. Az élettani szabályozás következtében csökken a vér glükóz koncentrációja.
2. Inzulinrezisztencia fogalma és jelentősége
Az inzulinrezisztencia (IR) az a állapot, amelyben a sejt, szövet vagy szervezet nem reagál megfelelően az inzulin hatásra, azaz csökken az inzulin által szabályozott glükózfelvétel és a glükoneogenézis gátlása.
(Magyarázat: Glükoneogenézis az a folyamat, amikor a glükóz szintézise nem szénhidrát előanyagokból, mint a zsírok glicerinjéből, a fehérjék egyes aminosavaiból, illetve az izmok által termelt tejsavból és piroszőlősavból.)

(forrás: Depositphotos_220705756_m-2015.jpg)
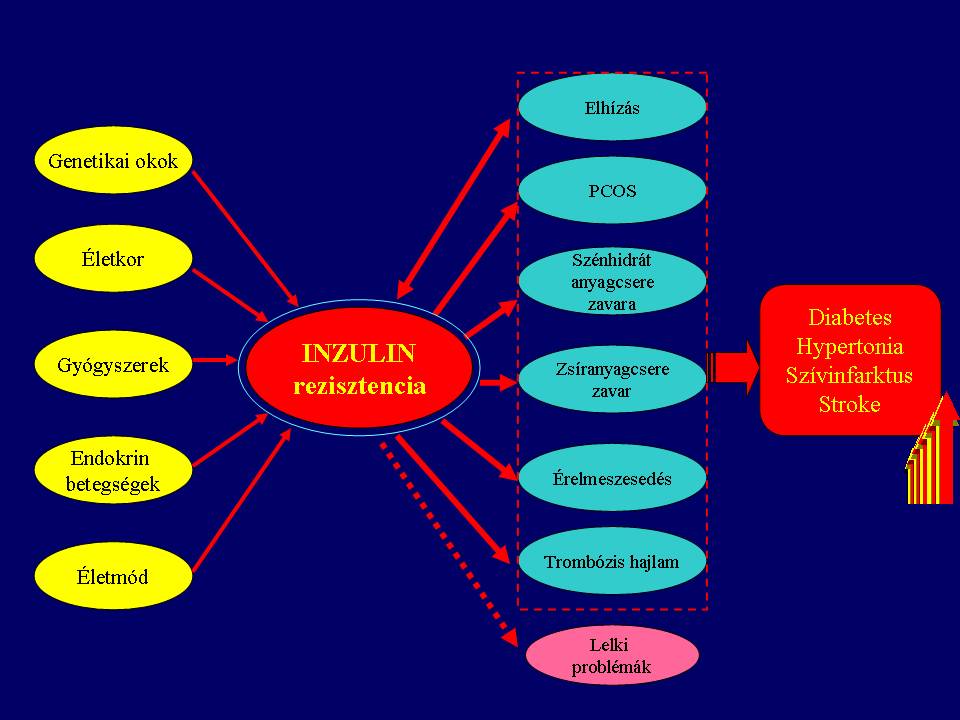
Az évekig vagy évtizedekig tünetmentes inzulinrezisztencia (IR) előbb-utóbb metabolikus szindrómához (MS) vezet. A MS az anyagcsere hatásai, érrendszeri (vaszkuláris), hormonális (endokrin), idegkárosító és a gyulladásos reakciója révén nemcsak magas vérnyomást, érelmeszesedést szív- és agyi infarktust, 2. típusú cukorbetegséget, depressziót, elhízást, szív- és érrendszeri (CV) betegségeket, 2. típusú cukorbetegséget (2-DM), depressziót és mindkét nemben szexuális funkciózavart is okozhat.
Az inzulinrezisztencia inzulin célszövetekben, köztük a májban, a vázizomban és a zsírszövetben a 2. típusú cukorbetegség felé történő folyamat korai szakasza. Az IR már évekkel a 2. típusú cukorbetegség (2DM) és az érelmeszesedés (ateroszklerózis) előtt kialakul, tehát az IR kórfolyamatának (patogenézisének) felderítése jelentheti a kulcslépést a 2DM és a kardiovaszkuláris betegségek megelőzésében és terápiájában.

(forrás: Depositphotos_43856005_m-2015.jpg)
3. Az inzulinrezisztencia kialakulásának mechanizmusai
Az inzulinrezisztencia kialakulásában komplex mechanizmusok szerepelnek, melyek nem mindegyike ismert és jelenleg is kutatások tárgya.
Az inzulinrezisztencia kialakulása elvileg négy fő csoportra osztható:
- 1. Receptorszintű okok
- 2. Sejt és szöveti szintű okok
- 3. Egyes endokrin betegségek
- 4. Életmód
Ezek a tényezőket, okokat, de a következményeket sem lehet mereven szétválasztani, gyakran egymással kombinálódhatnak, illetve befolyásolják egymás hatását. Az inzulinrezisztencia kialakulását és a következményesen kialakuló szövődményeket az életkor is befolyásolja.
Az inzulinrezisztencia okai és következményei
3.1. Receptorszintű okok
Az inzulinrezisztencia kialakulási mechanizmusának megértéséhez, az életmódbeli és a szöveti tényezőkön kívül - lényeges a receptorszintű okok megismerése is.
Magyarázat. Receptor: A sejtmembránon, a sejtmembránban vagy a sejtben lévő, kémiai változást érzékelő fehérje, amely észleli, ha bizonyos molekulák kapcsolódnak hozzá. Ennek következtében a sejtek működése megváltozik)
Lényeges annak ismerete, hogy az inzulin receptorok sűrűsége az inzulin koncentrációjától függ, ezért a receptorok száma is befolyásolja az inzulin hatásait!
Az inzulin receptor a membrán receptorok, ezen tirozin-kináz receptorok családjába tartozik. Az inzulin receptor transzmembrán glikoprotein, amely diszulfid hidakkal kovalensen összekapcsolt két α és két β alegységből áll. Az inzulin az extracelluláris (sejten kivüli) α alegységhez kötődik, a β alegység egy rövid extracelluláris részből, egy transzmembrán doménből, és egy intracelluláris (sejten belüli) részből áll, amely az inzulin által szabályozott tirozin kináz aktivitásért felelős.
(Magyarázat: A fehérjedomén a biokémiában egy fehérje harmadlagos szerkezetének funkcionális egysége.)
Inzulin távollétében az α alegység gátolja a β alegység tirozin kináz aktivitását. Az inzulin α alegységhez való kötődése olyan konformációváltozást okoz, amelynek hatására a β alegység felszabadul a gátlás alól. Ha magas a vér inzulinszintje, a receptorok sűrűsége csökken (downregulation), amennyiben magas, a receptorok száma nő (upregulation).
Az inzulinrezisztencia kialakulása komplex és a receptorokhoz (kötőhelyekhez) viszonyítva az alábbi okok miatt alakulhat ki:
- Pre-receptor: inzulin-ellenes antitest, megváltozott inzulinmolekula
- Receptor: csökkent receptor sűrűség (downregulation)
- Post-receptor: hibás információtovábbítás a sejt belseje felé
Az inzulinrezisztencia és az inzulin szint között tehát nincs mindig szoros kapcsolat. Ez azt is jelenti, hogy a terheléses vércukor során mért inzulin szintekből nem lehet mindig sejtszintű kóros következménnyel járó inzulinrezisztenciára következtetni.
3.2. Sejt és szöveti szintű okok
Sejtszinten az IR lokalizálódhat a máj, az izomzat, a zsírszövet – és újabb vizsgálatok alapján – az agyi folyamatok és a bélbaktériumok is részt vesznek az IR létrejöttében. Tekintettel arra, hogy IR férfiakban is kialakul, kicsi az esélye, hogy a női hormonok, kötőhelyeik (receptorok) döntő szerepet játszanak a kórkép kialakulásában.
3.2.1. Zsírszövet
Amíg régebben a zsírszövetet kizárólag passzív raktárnak tekintették, mára kiderült, hogy számos gyulladáskeltő fehérje, citokin termelődik elsősorban a hasi zsírszövetben. Ez az ún. alacsony fokozatú gyulladás IR-rel jár együtt, e kettő szoros kölcsönhatásban van egymással.
(forrás: Depositphotos_95124136_s-2019)
Barna zsírszövet
Klasszikus ismereteink szerint a barna zsírszövet felnőttekben csak kis mennyiségben van jelen. Újabban pozitron emissziós tomográfiás (PET) vizsgálattal fedezték fel, hogy elsősorban a szupraklavikuláris (kulcscsont feletti) árkokban barna zsírszövet helyezkedik el.
(Magyarázat: A pozitronemissziós tomográfia működése azon alapul, hogy pozitront sugárzó izotópokkal jelölt molekulák segítésével képes a szervezet biokémiai folyamatait ábrázolni.
E zsírsejtek – bár a klasszikus barna zsírsejtektől eltérően más őssejtekből származnak – a barna zsírsejtek fontos élettani tulajdonságaival rendelkeznek, átalakítják a táplálékból származó energiát hővé, így szabályozva az energia-egyensúlyt, javítva a glükóz-anyagcserét, csökkentve a testtömeg és az IR-t.
3.2.2. A cirkadián rendszer működészavara (CLOCk szisztéma szerepe)
Az inzulinrezisztencia kialakulásában, az utóbbi évek kutatása alapján, a cirkadián (napi ritmus) felborulása is szerepet játszhat. A cirkadián ritmus legfontosabb szabályozója a fény, amely a retina (a szem ideghártyája) megvilágításán keresztül a hipotalamusz megfelelő magcsoportjaihoz továbbít információkat.
(Magyarázat: A hipotalamus a központi idegrendszer része. Központi helyzete miatt közel van a felszálló és leszálló idegpályákhoz, és az agyalapi mirigyhez (hipofízis). Ennek következtében a hipotalamusz a szervezet minden fontos élettani működését befolyásolja.
Hipothalamusz
(forrás: Depositphotos_58732727_s-2019.jpg)
A fényszerepe a napi ritmusban
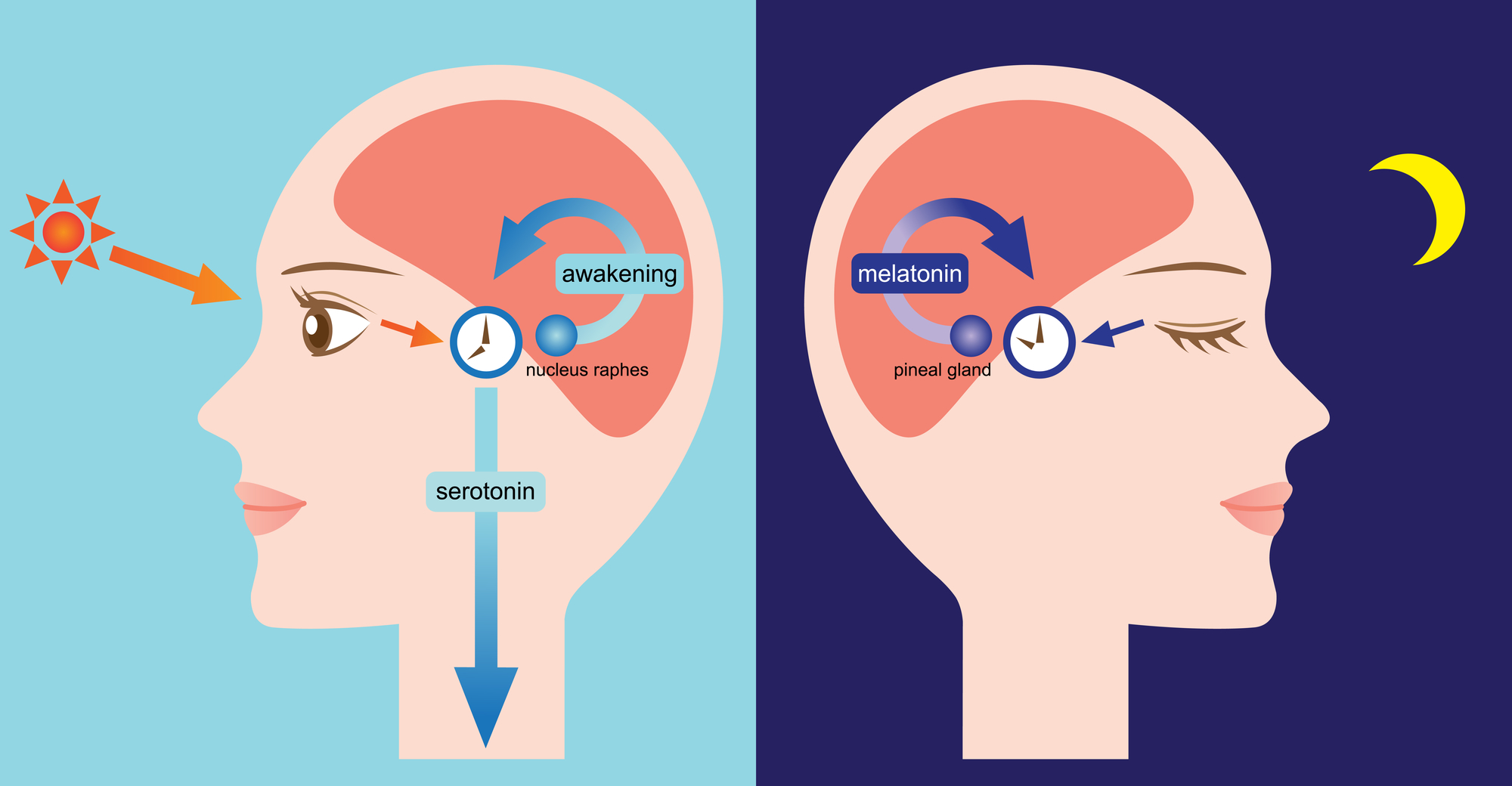
Depositphotos_95207484_l-2015.jpg
Ez a rendszer a legtöbb életfunkciónkat szabályozza. A rendszer szoros kapcsolatban van az agy megfelelő központjaival, kétirányú, bonyolult pályarendszeren keresztül. Ha ezen rendszer működésében zavar alakul ki, metabolikus, keringési és onkológiai rendellenességek léphetnek fel.
Mind állatkísérletek, mind humán megfigyelések bizonyították, hogy a kardiovaszkuláris, metabolikus folyamatoknak cirkadián ritmusa van. A váltott műszakban dolgozók, a tengerentúli repülőjáraton utazók megfigyelésével szerzett tapasztalatok igazolták, hogy a szabályos cirkadián ritmus megzavarása súlyos, életveszélyes állapotokhoz vezethet.
Feltételezik, hogy a rendszer „meghibásodása” akár T2DM kialakulásában is szerepet játszhat.
Máj és az izom inzulin érzékenységének élettani napszaki változása (napszaki ritmus)
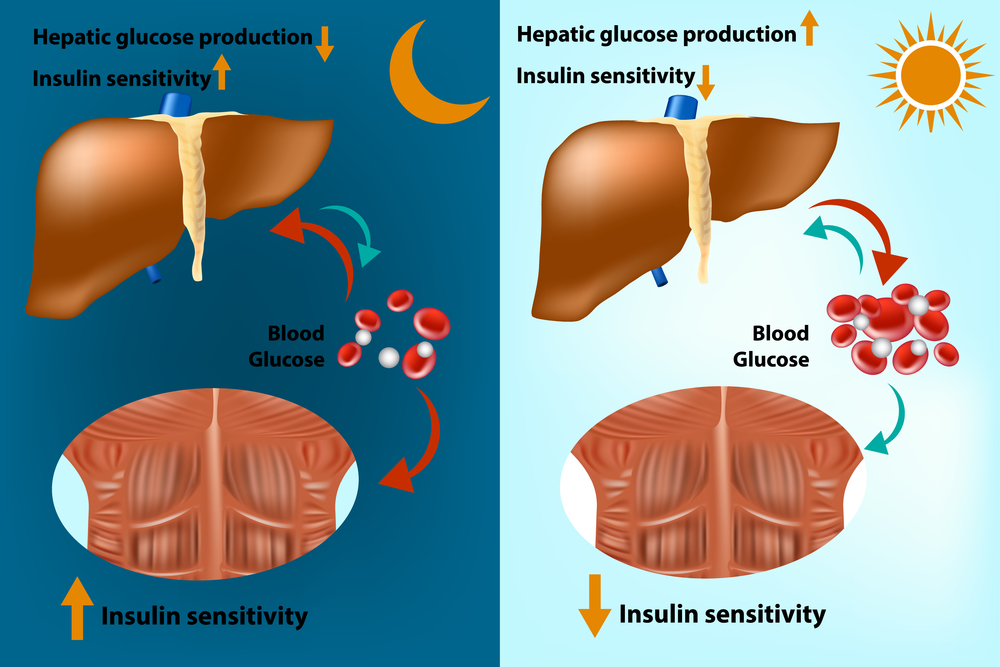
(forrás: Depositphotos_231309706_m-2015.jpg)
3.2.3. A bél baktérium flórájának szerepe
Régi-új felfedezés a bél baktériumflórájának (mikrobiota) szerepe az IR-ben, egyes metabolikus betegségekben. Az újabban a mikrobiotának nevezett bélflóra a földrajzi elhelyezkedés, az életkor, az alkat (kövér vs. sovány) szerint változik, sőt ugyanabban az egyénben akár rövid idő alatt is változhat a bélflóra összetétele. Kiderült, hogy jelentős befolyásoló szerepe van az étrendnek, így pl. a zsírdús étrend a felszívódásra, és a bélfal nyálkahártyájára gyakorolt hatás következtében a trillió nagyságrendű bélbaktériumok összetételét klinikai értelemben kedvezőtlenül alakítja.
Ugyanakkor a rostok bevitele kedvező hatású, belőlük fermentáció hatására olyan rövid szénláncú zsírsavak alakulnak, amelyek csökkentik az IR-t javítják a glükóz-anyagcserét, mérséklik az obesitást, növelik az inzulin iránti érzékenységet.
Állatkísérletek eredményei azt bizonyították, hogy kedvező baktérium összetételű széklet transzplantációja a transzplantált állat inzulinrezisztenciájának mérséklését eredményezte. Újabban kimutatták, hogy a belek baktérium flórája folyamatosan információkat küld az agyba, hálózatot képezve a mikrobiota, az agy, a PPAR rendszer és a CLOCK szisztéma között. Egyesek bél–agy-tengelyről beszélnek. E hálózat intakt működése kedvezően befolyásolja az elhízást, az IR-t, a 2-es típusú diabéteszt és a metabolikus eltéréseket.
3.2.4. A PPAR szisztéma szerepe
A PPAR (peroxisoma proliferátor aktiválta receptor) ligand (specifikusan kötő anyag) aktiválta magreceptor rendszer élettani és kórfolyamatokban játszott szerepe az utóbbi évek kutatásainak középpontjába került. A PPAR ugyanabba a magreceptor családba tartozik, mint amelyikbe a mellékvesekéreg szteroid hormon receptorai, valamint az ösztrogén-, a D-vitamin-, a tireoid-receptorok, illetve a retinoid-X-receptorok.
A PPAR receptorok befolyásolják a szénhidrát- és zsíranyagcserét, a zsírszövet differenciálódását és működését, részt vesznek az inzulinrezisztencia, a gyulladás, az atherogenesis és a daganatképződés folyamataiban. A PPAR rendszer az izomzat–bél–agy-tengely egyik fontos csomópontja és ez magreceptor rendszer szabja meg szervezetünk bonyolult összefüggéseit. Kóros körülmények között ez a szisztéma „meghibásodik”, melynek több területen is klinikai jelentősége van. Többek között felelősek az inzulinrezisztencia kialakulásáért is.
3.2.5. Az immunrendszer szerepe
A különböző veleszületett receptorok, mint Pattern Recognition Receptors (PRRs=mintázat felismerő receptorok), mint a Toll-like Receptors, (TLR) és a receptor for advanced glycation endproducts (RAGE) aktiválódnak diétás változások és a bél mikrobiota összetétele változásainak függvényében. A PRRs-ek aktivációja központi szerepet játszik a gyulladásos folyamat kifejlődésében. A ROR alfa és a ROR gamma (a CLOCK rendszer génjei) szintén fontos kapcsolatot teremtenek a cirkadián CLOCK rendszer és az általa szabályozott metabolikus folyamatok között. Újabban bizonyították, hogy a hypothalamus-hipofízis mellékvese (HPA) tengely is szerepet játszik az IR és a diabétesz kifejlődésében.
3.3. Inzulinrezisztenciát kiváltó hormonális állapotok
Az inzulin érzékenységének változásai számos endokrin rendellenesség során jelentkeznek. A hormonok többsége az inzulinra gyakorolt ellentétes hatásuk következtében a máj glükóz-kibocsátásának növekedéséhez és a perifériás szövetek csökkenéséhez vezet. Az endokrin betegségekben megfigyelt szénhidrát rendellenességek az inzulinrezisztencia jelenségéből erednek, és bizonyos esetekben az inzulinszekréció csökkenése is fennáll.
A glükóz és inzulin anyagcsere rendellenességei - a policisztás petefészek szindrómán (PCOS) kívül - kialakulhatnak még a következő hormonális állapotokban:
- az akromegáliában,
- növekedési hormonhiányban,
- mellékvese különböző működési zavaraiban (Cushing-szindrómában,
- hyperaldoszteronizmusban,
- feochromocitomában,
- a mellékvesék veleszületett fellépő hypercortisolizmus miatt),
- pajzsmirigy alul vagy túlműködésében (hyper- vagy hypothyreosis),
- mellékpajzsmirigy túlműködésében (elsődleges hyperparathyreosis, hipertrófia),
- nemi mirigyek (a herék és a petefészkek) bármely okból bekövetkező csökkent működése
- hormonálisan aktív neuroendokrin (hormontermelő) daganatok esetén.
3.4. Életmód
Az inzulinrezisztencia kialakulásában az életmódnak, az életvitelnek is jelentős szerepe van.

(forrás: Depositphotos_67037593_s-2019)
3.4.1. Táplálkozás
Az elhízás hátterében, amit kísérleti állatban magas zsírtartalmú étrend folyamatos adásával is ki lehet váltani, gyulladás és IR áll fenn. Az elhízás szorosan kapcsolódik az inaktív életmóddal. Az ide sorolt betegségek, mint PCOS, T2DM, MS, egyes daganatok, szív- és érrendszeri betegségek, bizonyos mentális kórképek, néhány mozgásszervi betegség az „inaktivitási betegségek” csoportjába tartoznak. E kórképek biológiai alapja az alacsony fokozatú gyulladás mellett az IR.
3.4.2. Mozgás jelentősége
Az intenzív izommunka általában javítja az IR-t, MS-ben, T2DM-ben terápiásan is felhasználjuk a rendszeres testedzést. Régóta ismert ugyanakkor, hogy egyes diabéteszes betegekben a testedzés paradox hatású, fokozza az IR-t, növeli a vércukor szintjét. Kiderült, hogy izom összehúzódás hatására több száz peptid termelődik, elsősorban az izomsejtek között elhelyezkedő zsírsejtekben (adipomyokinek), amelyek általában csökkentik az IR-t, a vércukorszintet. Ide sorolható a nemrégiben felfedezett hormon, az irisin, de termelődnek olyan peptidek is, amelyek ellentétesen hatnak, fokozzák az IR-t, ilyen pl. a myostatin. Myostatin-negatív egerek inzulinérzékenysége azonban nő, magas zsírtartalmú étrend (HFD=high fat diet) adására kevésbé reagálnak elhízással.
(Magyarázat: Peptid: A fehérjéknél rövidebb, kevesebb aminosavat tartalmazó molekulák.)
4. Az inzulinrezisztencia következményei
Az IR lényege a célsejtek közötti és a célsejteken (β-sejtek, máj, zsír és vázizom) belüli kommunikációs hibáinak kialakulása. Az inzulin hatásáért felelős jelátviteli utak károsodása a vércukorszint emelkedéséhez, a 2DM kialakulásához, végül a mikro- és makrovaszkuláris szövődmények megjelenéséhez vezet. Az inzulin hangolja össze a sejtek közötti és a sejteken belüli folyamatokat a zsírok raktározásától egészen a glükóz felhasználásáig.
Míg a fokozott β-sejtfunkció és a hyperinsulinemia kezdetben kompenzálja ezeket a szabályozatlan folyamatokat, a glükolipotoxicitás és a genetikai tényezők β-sejt-meghibásodáshoz és a 2. típusú cukorbetegség kialakulásához vezetnek.
Az egészségtelen életmód miatt kialakuló kalória-egyensúly zavar a zsír felhalmozódását is eredményezi a májban és a vázizomban, ami megakadályozza az inzulin hatását ezekben a szövetekben. Az ezt követő zsírsejt működési zavar elősegíti a makrofágok beszivárgását és növeli a lipolízist (zsírlebontást), és ez több szempontból is károsítja a máj szénhidrát- és lipid metabolizmusát. A megnövekedett zsírsav-fluxus elősegíti a zsírsav-észterezést és a máj trigliceridszintézisét, súlyosbítja a nem alkoholos zsírmáj betegséget (NAFLD) a máj nem alkoholos steatosisát (NASH), a máj inzulinrezisztenciáját és emeli a májsejtek triglicerid tartalmát. Az NAFLD-t sokan a metabolikus szindróma májbeli manifesztációjának tartják. A májsejtek trigliceridtartalmának növekedése együtt jár az egész szervezet, illetve a máj inzulinrezisztenciájával.
Egy lehetséges következménye a májbeli zsírsavkínálat növekedésnek a VLDL-túltermelődés, majd az atherogen dyslipidaemia és a zsírsavak fokozott oxidációja és peroxidációja, ami növeli a szervezet szabadgyök-terhelését. Ennek következtében kimerül az antioxidáns védekező rendszer és a gyulladást és az immunválaszt kiváltó mediátorok termelődése megnő.
Az inzulinrezisztencia következtében kompenzáló módon kialakuló hyperinsulinaemia (inzulin koncentráció emelkedése) hatására a fehérje felépítést serkentő hatások dominálnak. E hatások az érfali sejtek túlburjánzását okozva, szűkítik az erek lumenét, így eredményeznek kiterjedt érszűkületet, ateroszklerózist.
Arterosclerosis miatt kialakuló érlumen szükület
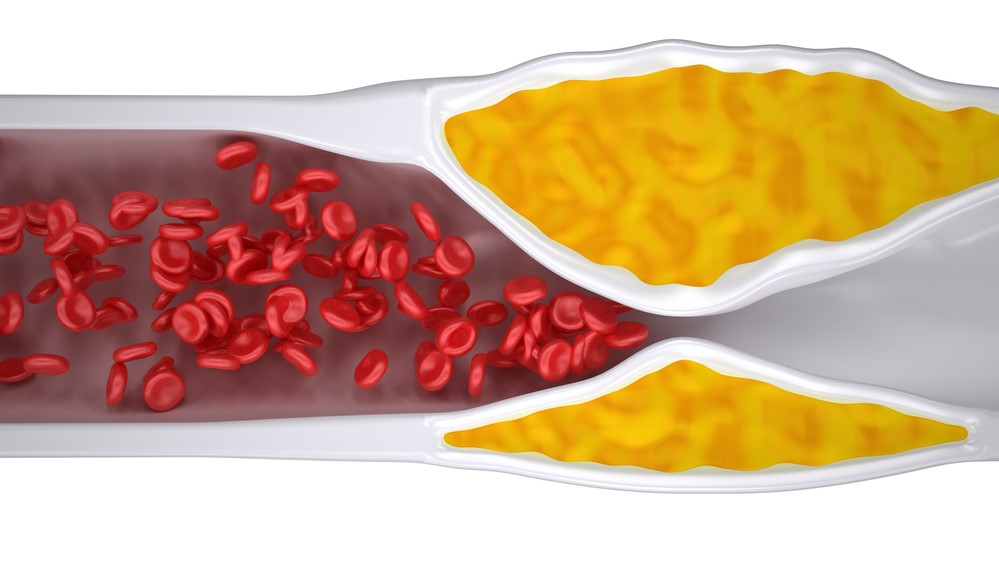
(forrás: Depositphotos_52858581_m-2015.jpg)
E hatásai révén az IR következtében kialakuló hyperinzulinaemia nemcsak diffúz érelmeszesedést, hanem daganatképződést is okozhat.
►Lásd még
A szénhidrát és az inzulin anyagcsere laboratóriumi vizsgálata
Az obesitas szénhidrát-inzulin hipotézise
Irodalom
- Czech M.P.: Insulin action and resistance in obesity and type 2 diabetes. Nat Med. 2017 Jul 11; 23(7): 804–814.
- Halmos T. és Suba I.: A metabolikus szindróma megváltozott felfogása. Metabolizmus, 2011, 9. évfolyam 1. szám
- Kang,S. és mtsai: Nuclear Mechanisms of Insulin Resistance. Trends Cell Biol. 2016 May; 26(5): 341–351.
- Samuel VT, Shulman GI. The pathogenesis of insulin resistance: integrating signaling pathways and substrate flux. J Clin Invest. 2016 Jan 4; 126(1): 12–22.
- Sira L. és mtsai: Anyagcsere-eltérések felnőttkori policisztás ovárium szindrómában. Metabolizmus, 2015, 13. évfolyam 5. szám
- Winkler G. és mtsai: A PPAR-rendszer és klinikai jelentősége. Diabetologia Hungarica, 11. (N°3.) 153-164, 2003.
Szeretne megoldást találni nőgyógyászati és endokrinológia panaszaival kapcsolatban? Szeretne javítani hormonegyensúlyán és egészségén?
Az alábbi problémákra nálam megnyugtató szakértői segítséget kap!
Nőgyógyászati panaszok • PCOS • Inzulinrezisztencia • Fokozott szőrnövekedés, pattanások • Elhízás • Meddőség • Pajzsmirigy- és mellékvese rendellenességek • Egyéb hormonális problémák.
Kattintson az alábbi lehetőségek egyikére.

.jpg)
.jpg)

.jpg)


.jpg)